ژن ها، سلول ها و حوزه های هوشی مغز

| گروه طرفداری تایمز علم |
|---|
| مبنای عصبی زیستی هوش انسان چیست؟ به نظر می رسد مغز برخی افراد کارآمدتر از مغز دیگران است. درک مبانی بیولوژیکی این تفاوت ها برای علوم اعصاب پایه و کاربردی بسیار مورد توجه است. به نوعی، راز باید در سلول های مغز ما نهفته باشد که با آن فکر می کنیم. با این حال، در حال حاضر، تحقیقات در مورد نوروبیولوژی هوش بین دو استراتژی اصلی تقسیم میشود: مطالعات تصویربرداری مغز ساختار و عملکرد ماکروسکوپی مغز را برای شناسایی نواحی مغز درگیر در هوش بررسی میکند، در حالی که مطالعات انجمنهای ژنتیکی با هدف تعیین دقیق ژنها و مکانهای ژنتیکی مرتبط با هوش انجام میشوند. هیچ چیز در مورد چگونگی ارتباط خواص سلول های مغز با هوش مشخص نیست. با این حال، ظهور رونویسی و علوم اعصاب سلولی هوش ممکن است، راهبرد سوم را ارائه کرده و شکاف بین ژن های شناسایی شده برای هوش و عملکرد و ساختار مغز را پر می کند. در اینجا، آخرین تحولات در جستجوی پایه بیولوژیکی هوش را مورد بحث قرار می دهیم. به ویژه، اخیراً در دسترس بودن گروههای بسیار بزرگ با صدها هزار نفر، پیشرفتهای هیجانانگیزی در ژنتیک هوش ایجاد کرده است. علاوه بر این، اولین مطالعاتی را که نشان میدهند جمعیت خاصی از سلولهای مغز با هوش مرتبط هستند، مورد بحث قرار میدهیم. در نهایت، ما نشان میدهیم که چگونه ژنهای خاصی که شناسایی شدهاند، ویژگیهای سلولی مرتبط با هوش را ایجاد میکنند و ممکن است در نهایت ساختار و عملکرد مناطق درگیر مغز را توضیح دهند. بدین ترتیب، راه برای درک سلولی هوش هموار می شود |
| هوش چیست؟ |
|---|
|
به طور شهودی همه ما می دانیم که باهوش بودن چیست، اگرچه تعاریف هوش می تواند بسیار متنوع باشد. این چیزی است که به ما کمک می کند برنامه ریزی کنیم، استدلال کنیم، مشکلات را حل کنیم، به سرعت یاد بگیریم، روی پای خود فکر کنیم، تصمیم بگیریم و در نهایت در دنیای سریع و مدرن زنده بمانیم. برای درک این ویژگی گریزان، آزمونهای شناختی برای اندازهگیری عملکرد در حوزههای شناختی مختلف، مانند سرعت پردازش و زبان طراحی شدهاند. خیلی زود مشخص شد که نتایج آزمونهای شناختی مختلف بسیار همبسته هستند و عامل کلی قوی را ایجاد میکنند که زیربنای قابلیتهای مختلف است - هوش عمومی یا g Spearman ( Spearman, 1904 ). یکی از پرکاربردترین تست های امروزه برای تخمین g Spearmanمقیاس هوشمند بزرگسالان وکسلر (WAIS) است. این آزمون نتایج چندین آزمون شناختی را در یک اندازه گیری، نمره IQ در مقیاس کامل ترکیب می کند. |
|
آیا آزمون ها قادر به اندازه گیری هوش انسان هستند و آیا بیان آن در یک عدد - نمره IQ - منطقی است؟ علیرغم انتقادهایی که از این رویکرد تقلیل گرایانه به هوش وارد شده است، آزمون ها اعتبار و ارتباط خود را ثابت کرده اند. اول، نتایج آزمونهای IQ به شدت با نتایج زندگی، از جمله وضعیت اجتماعی-اقتصادی و توانایی شناختی، حتی زمانی که در اوایل زندگی اندازهگیری میشوند، همبستگی دارد ( فورسکوف و همکاران، 2017 ). پیچیدگی روزافزون و جامعه وابسته به فناوری، تقریباً در هر جنبه ای از زندگی روزمره، مانند بانکداری، استفاده از نقشه ها و برنامه های حمل و نقل، خواندن و درک فرم ها، تفسیر مقالات خبری، تقاضاهای شناختی فزاینده ای را بر افراد تحمیل می کند. هوش بالاتر مزایای به ظاهر کوچک بسیاری را ارائه می دهد، اما آنها برای تأثیرگذاری بر شانس کلی زندگی افراد جمع می شوند. (گوتفردسون، 1997 ). اینها برای وضعیت اجتماعی-اقتصادی، تحصیلات، تحرک اجتماعی، عملکرد شغلی و حتی انتخاب سبک زندگی و طول عمر مفید هستند ( لام و همکاران، 2017 ). |
|
دوم، معلوم می شود که هوش یک ویژگی بسیار پایدار از جوانی تا پیری در همان فرد است. در یک مطالعه طولی بزرگ روی کودکان انگلیسی، همبستگی 0.81 بین هوش در 11 سالگی و نمرات آزمون های ملی پیشرفت تحصیلی 5 سال بعد مشاهده شد. این سهم هوش در تمام 25 رشته دانشگاهی مشهود بود ( Deary et al., 2007 ). حتی در سنین بسیار بالاتر، هوش ثابت باقی می ماند: یک آزمون تکی هوش عمومی که در سن 11 سالگی انجام شد، با نتایج آزمون در سن 90 سالگی همبستگی زیادی داشت ( Deary et al., 2013 ). |
|
در نهایت، یکی از قابل توجهترین یافتههای مطالعات دوقلو این است که وراثتپذیری هوش فوقالعاده بزرگ است، در محدوده 50% تا 80% حتی برای IQ کلامی به 86% میرسد ( Posthuma et al., 2001 ). این امر هوش انسان را به یکی از ارثی ترین ویژگی های رفتاری تبدیل می کند ( پلومین و دیاری، 2015 ). علاوه بر این، با هر نسل، جفتگیری ترکیبی واریانس ژنتیکی افزودنی را به جمعیت تزریق میکند و به این وراثتپذیری بالا کمک میکند ( Plomin and Deary, 2015 ). |
|
بنابراین، هوش علیرغم ناممکن بودن آن در تعریف، هسته اصلی تفاوتهای فردی انسانها است. میتوان آن را با آزمونهای شناختی اندازهگیری کرد و نتایج چنین آزمونهایی اعتبار و ارتباط آنها را ثابت کرده است: معیارهای هوشی در اضافه کاری پایدار هستند، وراثت پذیری بالایی را نشان میدهند و پیامدهای اصلی زندگی را پیشبینی میکنند. |
|
مبنای بیولوژیکی هوش: دیدگاه کل مغز |
|---|
|
سوالی که قرن هاست دانشمندان را متحیر کرده است، منشا هوش انسان است. چه چیزی برخی افراد را باهوش تر از دیگران می کند؟ تلاش برای پاسخ به این سؤالات از اوایل دهه 1830 در اروپا و روسیه آغاز شد، جایی که مغز دانشمندان و هنرمندان نخبه متوفی به طور سیستماتیک جمع آوری و به طور دقیق مورد مطالعه قرار گرفت ( وین و مات-شیمن، 2008 ). با این حال، تمام تلاش ها برای کالبد شکافی توانایی و استعداد استثنایی در آن زمان چیز زیادی را آشکار نکرد. |
|
فرضیه حاکم در قرن گذشته این بود که افراد باهوش تر مغزهای بزرگتری دارند. با پیشرفت در تکنیک های تصویربرداری عصبی، این فرضیه در بسیاری از مطالعات مورد آزمایش قرار گرفت. در واقع، یک متاآنالیز از 37 مطالعه با بیش از 1500 نفر در مورد رابطه بین حجم مغز درون تنی و هوش یک همبستگی مثبت متوسط و در عین حال قابل توجه 0.33 را نشان داد ( مک دانیل، 2005 ). یک متا مطالعه جدیدتر از 88 مطالعه با بیش از 8000 نفر مجدداً ضریب همبستگی قابل توجه، مثبت و کمی کوچکتر 0.24 را گزارش کرد. یکی از نتایج این مطالعه این بود که به نظر می رسد قدرت ارتباط حجم مغز و ضریب هوشی در ادبیات بیش از حد برآورد شده است، اما پس از محاسبه سوگیری انتشار، قوی باقی می ماند ( Pietschnig et al., 2015).). بنابراین، به طور کلی حجم بزرگتر مغز، زمانی که در مطالعات متعدد مورد تجزیه و تحلیل قرار گیرد، با هوش بالاتر مرتبط است. |
|
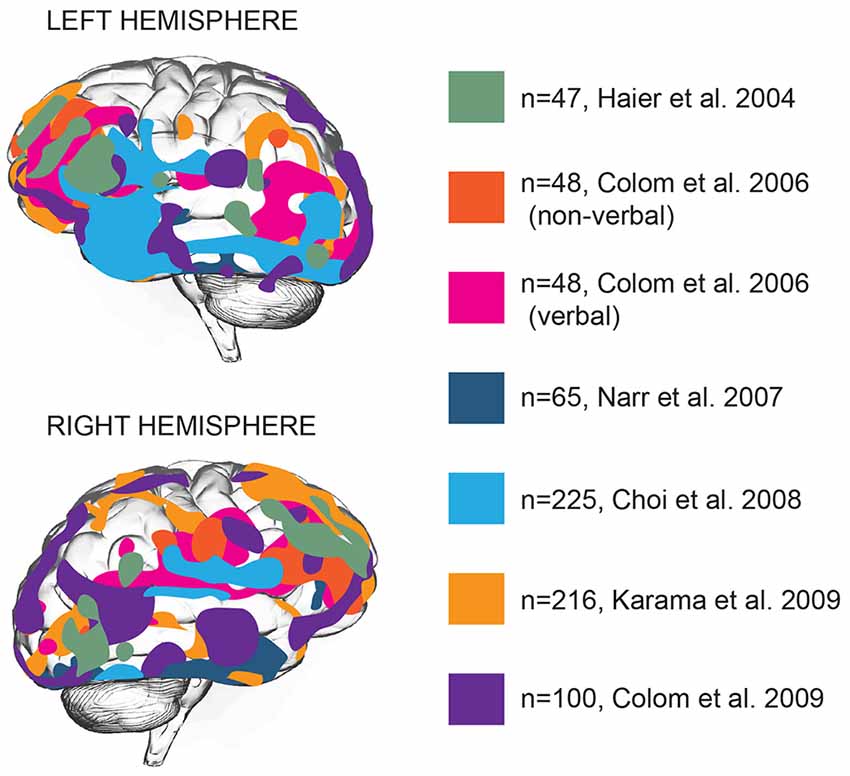
کدام نواحی مغز برای هوش مهم هستند؟ عملکرد مغز در مناطق مختلفی که دارای عملکردهای خاصی هستند توزیع می شود. آیا می توان هوش را به یک یا چند مورد از این حوزه ها نسبت داد؟ مطالعات تصویربرداری ساختاری و عملکردی مغز بر روی مکان یابی هوش عمومی در مغز و پیوند انواع خاصی از شناخت به نواحی خاص مغز متمرکز بود ( Deary et al., 2010 ). مطالعات اولیه تصویربرداری مرتبط با هوش به ساختار مغز نشان داد که نمرات IQ در مقیاس کامل، معیاری برای هوش عمومی، الگوی گسترده ای از همبستگی با ساختارهای مغز را نشان می دهد: نمرات IQ با حجم داخل جمجمه، مغزی، لوب گیجگاهی، هیپوکامپ و مخچه مرتبط است. آندریسن و همکاران، 1993) که روی هم تقریباً تمام نواحی مغز را در بر می گیرد. مورفومتری مبتنی بر وکسل (VBM)، یک تکنیک تجزیه و تحلیل تصویربرداری عصبی است که امکان تخمین تفاوتهای کانونی در ساختار مغز را فراهم میکند، این امکان را فراهم میکند که آیا چنین مناطقی در کنار هم قرار گرفتهاند یا در سراسر مغز توزیع شدهاند. استفاده از VBM در دادههای تصویربرداری مغز نشان داد که همبستگی مثبت بین هوش و ضخامت قشر مغز عمدتاً در نواحی ارتباطی متعدد لوبهای پیشانی و تمپورال قرار دارد ( Hulshoff Pol et al., 2006 ; Narr et al., 2007 ; Choi et al., 2008). ؛ کاراما و همکاران، 2009 ). بر اساس 37 مطالعه تصویربرداری عصبی، یونگ و حایر (2007)بیان کرد که به ویژه ساختار نواحی فرودمان 10، 45-47، نواحی جداری 39 و 40، و ناحیه زمانی 21 به طور مثبت به نمرات IQ کمک می کند ( یونگ و هایر، 2007 ). این مدل توسط مطالعات بعدی به میدان چشم پیشانی، ناحیه اربیتو فرونتال و همچنین تعداد زیادی از نواحی در لوب گیجگاهی - شکنج گیجگاهی تحتانی و میانی، قشر پاراهیپوکامپ و قشر انجمن شنوایی ( نار و همکاران، 2007 ؛ چوی و همکاران) گسترش یافت. .، 2008 ؛ کولوم و همکاران، 2009 ؛ شکل 1 ). |
|
شکل 1 . ضخامت ماده خاکستری نواحی متعدد قشر مغز با هوش عمومی ارتباط دارد. نواحی مغز با ارتباط معنیدار بین ضخامت قشر مغز و هوش عمومی در مطالعات مختلف با رنگهای مختلف نشان داده میشوند. N عدد نشان دهنده اندازه نمونه است. در همه موارد، حوزه های مرتبط با هوش عمومی نشان داده شده است، به استثنای مطالعه کلوم و همکاران (2006) ، که در آن هوش کلامی و غیرکلامی به طور جداگانه گزارش شده است ( Hier et al., 2004 ; Colom et al. ، 2006 ، 2009 ؛ نار و همکاران، 2007 ؛ چوی و همکاران، 2008 ؛ کاراما و همکاران، 2009 ). |
|
تغییرات ساختار مغز ساختار مغز در یک نقطه زمانی رشد خاص ثابت نیست و سپس تا پایان عمر ما بدون تغییر باقی می ماند. حجم ماده خاکستری در دوران کودکی و همچنین بزرگسالی تغییر می کند ( Gogtay et al., 2004 ) و تحت تأثیر یادگیری، تفاوت های هورمونی، تجربه و سن قرار می گیرد. تغییرات ماده خاکستری ممکن است بازآرایی دندریت ها و سیناپس ها بین نورون ها را منعکس کند ( Gogtay et al., 2004 ). هنگامی که افراد مهارت جدیدی به دست می آورند، برای مثال شعبده بازی، تغییرات ساختاری گذرا و انتخابی در نواحی مغز مشاهده می شود که با پردازش و ذخیره سازی حرکت بصری پیچیده مرتبط است ( دراگانسکی و همکاران، 2004).). به طور مشابه، تفاوتهای جنسی و تفاوتهای سنی عوامل مهمی هستند که بر ساختار مغز تأثیر میگذارند و میتوانند بر روی ناحیههای قشر مغز تأثیر بگذارند. تفاوت های جنسی قابل توجهی در الگوی همبستگی بین هوش و حجم ماده خاکستری و سفید منطقه ای گزارش شد ( هایر و همکاران، 2005 ؛ نار و همکاران، 2007 ؛ یانگ و همکاران، 2014 ؛ رایمن و همکاران، 2016 )، اما گزارش ها در مورد نواحی مغزی که تفاوت های جنسی را نشان می دهند یا ارتباط آنها با عملکرد شناختی کاملاً موافق نیستند. حایر و همکاران (2005) همبستگی ضریب هوشی را با نواحی جداری و پیشانی در مردان گزارش کرد، در حالی که زنان به طور عمده در لوب فرونتال همبستگی را نشان دادند ( Hier et al., 2005 ). نتایج مشابهی توسط رایمن و همکاران به دست آمد. (2016)در مردان - ماده خاکستری فرونتوپریتال به طور قابل توجهی با توانایی شناختی عمومی مرتبط بود. با این حال، در زنان، نتایج نشان دهنده ارتباط با هوش در کارایی ماده سفید و حجم کل ماده خاکستری بود ( Ryman et al., 2016 ). با این حال نتایج متفاوتی توسط نار و همکاران گرفته شد. (2007) ، که در آن زنان ارتباط قابل توجهی را در ضخامت ماده خاکستری در قشرهای ارتباطی پیش پیشانی و گیجگاهی نشان دادند، در حالی که مردان عمدتاً در قشرهای ارتباطی گیجگاهی - پس سری نشان دادند ( نار و همکاران، 2007).). در نهایت، در یک مطالعه اخیر که در آن مورفومتری مبتنی بر سطح (SBM) به جای VBM استفاده شد، تفاوتهای گروهی قابلتوجهی در ساختار مغز بین جنسها مشاهده شد، اما عملکرد شناختی با تغییرات ساختاری مغز در درون و بین جنسها ارتباطی نداشت ( اسکوریال و همکاران، 2015). ). آنچه مطالعات بر روی آن اتفاق نظر دارند این است که تفاوتهای جنسی قابل توجهی در ساختار مغز وجود دارد، اما این تفاوتها همیشه زمینه ساز تغییرات در عملکرد شناختی نیستند. به عنوان مثال، یکی از تفاوت های جنسی ثابت شده در ساختار مغز، افزایش ضخامت قشر مغز مردان در مقایسه با زنان است ( Lüders et al., 2002 )، اما روابط بین نمره IQ در مقیاس کامل و حجم بافت مغز در مردان تفاوتی ندارد. و زنان ( نار و همکاران، 2007 ؛ اسکوریال و همکاران، 2015 ). |
|
سن مهم است علاوه بر تفاوت های جنسی، حجم ماده خاکستری تغییرات چشمگیری را در طول زندگی نشان می دهد که بخشی از رشد طبیعی است ( Gogtay et al., 2004 ). افزایش اولیه در سنین پایین با لاغری مداوم در حوالی بلوغ به دنبال دارد. تصور می شود که این تغییر رشدی در نتیجه تولید بیش از حد سیناپس ها در اوایل کودکی و افزایش هرس سیناپسی در نوجوانی و بزرگسالی باشد ( بورژوا و همکاران، 1994 ). علاوه بر این، نواحی مختلف جدول زمانی بلوغ خود را دارند: قشرهای ارتباطی مرتبه بالاتر تنها پس از قشرهای حسی تنی و بصری مرتبه پایین بالغ می شوند ( Gogtay et al., 2004).). همبستگی با هوش از منحنی رشد مشابهی پیروی می کند. قویترین همبستگیها بین حجم ماده خاکستری و هوش برای کودکان حدود 10 سال یافت شده است ( شاو و همکاران، 2006 ؛ یونگ و هایر، 2007 ). با این حال، در سن 12 سالگی، در حدود شروع نازک شدن قشر مغز، یک رابطه منفی ظاهر می شود ( بروور و همکاران، 2014 ). علاوه بر این، به نظر می رسد که کل الگوی بلوغ قشر مغز در کودکان باهوش تر به طور متفاوتی آشکار می شود. کودکان با ضریب هوشی بالاتر، قشر پلاستیکی خاصی را نشان می دهند، با فاز اولیه تسریع شده و طولانی افزایش قشر و نازک شدن قشر به همان اندازه شدید در اوایل نوجوانی ( شاو و همکاران، 2006 ). |
|
تخصص مغز در انواع مختلف هوش علاوه بر ارتباط ساختار قشر با هوش، مطالعات تصویربرداری همبستگی فعال سازی عملکردی نواحی قشر مغز را با هوش نشان داده است. روانشناسی بین دو نوع هوش که مجموعاً g Spearman را تشکیل می دهند تمایز قائل می شود: هوش متبلور و سیال. هوش متبلور مبتنی بر دانش و تجربه قبلی است و شناخت کلامی را منعکس می کند، در حالی که هوش سیال به استدلال انطباقی در موقعیت های جدید نیاز دارد ( کارول، 1993 ؛ انگل و همکاران، 1999 ). مطالعات متعدد حاکی از آن است که هوش مایع بر عملکرد کارآمدتر نواحی قشر پراکنده تکیه دارد ( دانکن و همکاران، 2000 ؛ یونگ و هایر، 2007 ؛ چوی و همکاران، 2008 ). به طور خاص، قشر فرونتال جانبی، با نقش ثابت خود در استدلال، توجه و حافظه کاری، به نظر می رسد از هوش سیال پشتیبانی می کند، اما لوب جداری نیز دخیل است. یکی از مطالعات قبلی هوش سیال با استفاده از ماتریس های پیشرفته پیشرونده ریون توسط هایر و همکاران. (1988) فعال شدن چندین ناحیه در نیمکره چپ، به ویژه قشر خلفی را نشان داد. عملکرد شناختی همبستگی منفی قابل توجهی با نرخ متابولیک قشر مغز نشان داد، که نشان دهنده مدارهای عصبی کارآمدتر است.حایر و همکاران، 1988 ). در مطالعات بعدی، هوش مایع به شدت با عملکرد و ساختار نواحی لوب فرونتال مرتبط بود ( چوی و همکاران، 2008 ). هنگامی که شرکتکنندگان نسخههای کلامی و غیرکلامی یک کار چالشبرانگیز حافظه کاری را انجام میدهند، در حالی که فعالیت مغز آنها با استفاده از تصویربرداری تشدید مغناطیسی عملکردی (fMRI) اندازهگیری میشود، افراد با هوش مایع بالاتر دقیقتر هستند و فعالیت عصبی مرتبط با رویداد بیشتری در جلوی پیشانی و جلوی مغزی جانبی دارند. نواحی جداری ( گری و همکاران، 2003 ). همچنین در یک مطالعه PET-اسکن، شرکتکنندگان انتخاب انتخابی قشر پیشانی جانبی را در طی کارهای شناختی پیچیدهتر در مقایسه با کارهای سادهتر نشان دادند ( دانکن و همکاران، 2000).). در یک گزارش جدیدتر، اندازهگیری حجم ماده خاکستری دو ناحیه پیشانی - مداری- پیشانی (OFC) و قشر کمربندی قدامی منقاری (rACC) - با اتصال ماده سفید بین این مناطق تکمیل شد. حجم ماده خاکستری سمت چپ و اتصال ماده سفید بین OFC خلفی سمت چپ و rACC تا 50 درصد از واریانس هوش عمومی را به خود اختصاص دادند. بنابراین، به ویژه در قشر پیش پیشانی، ساختار، عملکرد و اتصال همه به هوش عمومی، به ویژه به توانایی استدلال و حافظه کاری مربوط می شود ( اوهتانی و همکاران، 2014 ). از سوی دیگر، هوش متبلور که تا حد زیادی به توانایی کلامی متکی است، بیشتر به ساختار قشر و ضخامت قشر در نواحی جانبی لوب های تمپورال و قطب تمپورال بستگی دارد ( چوی و همکاران، 2008 ؛ کولوم و همکاران، 2009 ). در حالی که نواحی جداری (ناحیه برادمن 40) در درگیری آنها در هوش متبلور و سایر انواع همپوشانی نشان می دهند، ناحیه برودمن زمانی 38 منحصراً در هوش متبلور دخیل است. این یافته ها به خوبی با عملکرد لوب گیجگاهی هماهنگ است - تصور می شود که مسئول ادغام اطلاعات معنایی متنوع از مناطق مجزای مغز است. مطالعات بیماران مبتلا به زوال عقل معنایی از نقش لوب گیجگاهی در حافظه کاری معنایی و همچنین ذخیره حافظه پشتیبانی می کند ( Gainotti, 2006 ). بنابراین، تقسیم g Spearman توزیعهای قشری متمایز درگیر در زیر دامنههای هوش را نشان میدهد. این احتمال وجود دارد که تقسیم بیشتر هوش سیال و متبلور، به عنوان مثال در درک کلامی، حافظه کاری، سرعت پردازش و سازماندهی ادراکی، منجر به نقشه تعریفشدهتری از نواحی قشر مغز در نیمکره چپ و راست شود که به این زیر دامنههای هوش مربوط میشود. یونگ و حایر، 2007 ). |
|
ماده سفید و هوش نه تنها ماده خاکستری، بلکه حجم ماده سفید نیز ارتباطی با هوش نشان می دهد که می تواند با منشاء ژنتیکی مشترک توضیح داده شود ( پوستوما و همکاران، 2002 ). ماده سفید متشکل از آکسون های میلینی است که اطلاعات را از یک ناحیه مغز به ناحیه دیگر منتقل می کند و یکپارچگی دستگاه های ماده سفید برای عملکرد طبیعی شناختی ضروری است. بنابراین، الگوهای خاص عدم اتصال ماده سفید با عوامل شناختی عمومی و آسیب شناسی روانی ارثی مرتبط است ( Alnæs et al., 2018 ). به عنوان مثال، یو و همکاران. (2008)دریافتند که بیماران عقب ماندگی ذهنی آسیب گسترده ای را در یکپارچگی دستگاه های ماده سفید نشان می دهند که با ناهمسانگردی کسری ارزیابی شد. نمرات IQ به طور قابل توجهی با یکپارچگی چندین دستگاه ماده سفید در هر دو گروه کنترل سالم و بیماران عقب مانده ذهنی همبستگی دارد ( یو و همکاران، 2008 ). این همبستگی به ویژه در فاسیکلوس غیرسینه راست که بخشهایی از لوب تمپورال را با نواحی لوب فرونتال متصل میکند برجسته بود ( یو و همکاران، 2008 ). این نتایج از یافتههای قبلی در مورد ارتباط حجم ماده خاکستری لوب گیجگاهی و فرونتال و هوش حمایت میکند ( Hulshoff Pol et al., 2006 ; Narr et al., 2007 ; Choi et al., 2008 ; Karama et al., 2009.) و تاکید می کنند که اتصال دست نخورده بین این مناطق برای هوش مهم است. مطالعات طولی که تغییرات ماده سفید را در طول رشد و در طول پیری دنبال میکنند نیز نشان میدهند که تغییرات در ماده سفید با تغییر در هوش همراه است. در طول بلوغ مغزی در کودکان، ساختار ماده سفید با هوش ارتباط دارد. در یک نمونه بزرگ ( 778 نفر) از کودکان 6 تا 10 ساله، ریزساختار ماده سفید مستقل از سن با هوش غیرکلامی و توانایی دیداری-فضایی مرتبط بود ( Muetzel et al., 2015 ). در مطالعه دیگری، جایی که ماده سفید در کودکان در حال رشد معمولی در مقابل یادگیرندگان در حال مبارزه مورد مطالعه قرار گرفت، کارایی ماده سفید ارتباط قوی با هوش و پیشرفت تحصیلی در هر دو گروه مرتبط بود ( Bathelt et al., 2018 ). همچنین در مراحل بعدی زندگی، تغییرات در ریزساختار ماده سفید با تغییرات در هوش همراه است ( ریچی و همکاران، 2015 ). همبستگی قابل توجهی از 12 دستگاه اصلی ماده سفید با هوش عمومی در افراد مسن یافت شد ( Penke et al., 2012 ). تجزیه و تحلیل بعدی نشان داد که یکپارچگی دستگاه ماده سفید پایین تر از طریق کاهش سرعت پردازش اطلاعات، تأثیر منفی قابل توجهی بر هوش عمومی دارد ( Penke et al., 2012 ). بنابراین، فیبرهای آکسونی دست نخورده در سراسر مغز، زیرساخت عصبی آناتومیکی را برای پردازش سریع اطلاعات در شبکههای گسترده مغز فراهم میکنند و از هوش عمومی پشتیبانی میکنند ( Penke et al., 2012 ). |
|
نتیجه گیری در مورد توزیع ناخالص مغزی هوش بنابراین، هم مطالعات تصویربرداری عصبی عملکردی و هم ساختاری نشان میدهد که هوش عمومی را نمیتوان به یک منطقه خاص نسبت داد. درعوض، هوش توسط یک شبکه توزیع شده از نواحی مغز در بسیاری، اگر نگوییم همه، قشرهای ارتباطی مرتبه بالاتر، که به عنوان شبکه جداری- پیشانی نیز شناخته می شود، پشتیبانی می شود ( یونگ و هایر، 2007 ؛ شکل 1 ). این شبکه شامل تعداد زیادی نواحی - قشر جلوی پیشانی پشتی جانبی، لوب جداری و سینگولیت قدامی، چندین ناحیه در داخل لوب گیجگاهی و پس سری و در نهایت، مجاری ماده سفید اصلی است. برخی از تقسیم بندی محدود عملکرد را می توان مشاهده کرد که شامل نواحی فرونتال و جداری در هوش سیال، لوب های زمانی در هوش متبلور و یکپارچگی ماده سفید در سرعت پردازش است. اگرچه مطالعات تصویربرداری مغز همبستگی های آناتومیکی و عملکردی هوش انسانی را شناسایی کرده اند، ضرایب همبستگی واقعی به طور مداوم در حد متوسط بوده است، در حدود 0.15-0.35 (Hulshoff Pol et al., 2006 ; Narr et al., 2007 ; Choi et al., 2008 ; کاراما و همکاران، 2009). به احتمال زیاد دلایل مختلفی برای این وجود دارد، اما یک نتیجه گیری مهم این است که هوش انسان را تنها می توان تا حدی با ساختار مغز و فعال سازی عملکردی نواحی قشری مشاهده شده در MRI توضیح داد. عوامل دیگری نیز در ایجاد هوش موثر هستند که باید در نظر گرفته شوند. برای قرار دادن آن در یک دیدگاه تکاملی، مغز انسان در مقایسه با گونههای دیگر دارای قابلیتهای شناختی برجستهای است که شامل بسیاری از تواناییهای خاص انسانی - تفکر انتزاعی، زبان و خلاقیت است. با این حال، آناتومی مغز انسان چندان متمایز از سایر گونههای پستانداران نیست و نمیتواند به طور رضایتبخشی برای جهش تکاملی مشخص در هوش توضیح دهد. مغز انسان هم از نظر اندازه و هم از نظر تعداد عصبی، از نظر تکاملی متمایز نیست: فیلها و نهنگها مغز بزرگتری دارند ( مانگر و همکاران، 2013).و قشر نهنگ خلبان باله بلند حاوی نورون های بیشتری (37 میلیارد) نسبت به انسان است (19-23 میلیارد؛ پاککنبرگ و گاندرسن، 1997 ؛ هرکولانو-هوزل، 2012 ؛ مورتنسن و همکاران، 2014 ). به خصوص مغز نزدیک ترین همسایگان ما در مقیاس تکاملی، نخستی های غیر انسانی، شباهت قابل توجهی از خود نشان می دهد. در واقع، مغز انسان از نظر تشریحی از هر نظر یک مغز پستاندار با مقیاس خطی است ( Herculano-Houzel, 2012).، و به نظر می رسد ویژگی های استثنایی یا خارق العاده کمی دارد که می توان توانایی های شناختی برجسته را به آن نسبت داد. بنابراین، پاسخ به منشأ هوش انسانی و تنوع آن بین افراد به احتمال زیاد تنها در آناتومی ناخالص مغز نهفته است، بلکه باید در سطح بلوکهای سازنده و واحدهای محاسباتی آن - نورونها، سیناپسها و ژنتیک آنها جستجو شود. آرایش. |
| رویکرد ژنتیکی به هوش |
|---|
|
با توجه به اینکه هوش یکی از وراثت پذیرترین صفات است، نتیجه می شود که همبستگی های عصبی زیستی آن نیز باید تحت تأثیر ژنتیکی قوی باشد. در واقع، هم ماده خاکستری و هم ماده سفید کورتیکال، شیب شباهت را در افراد با افزایش میل ژنتیکی نشان می دهند ( Thompson et al., 2001 ; Posthuma et al., 2002 ). این شباهت ساختاری مغز به ویژه در نواحی گیجگاهی پیشانی و جانبی قوی است که بیشترین وراثت پذیری را نشان می دهد ( Thompson et al., 2001 ). از این رو، حجم کلی مغز به هوش مرتبط است و تا حد زیادی منشا ژنتیکی مشترک دارد. چگونه و چه زمانی در طول رشد تأثیر ژنتیکی توسط ژنهای فردی اعمال میشود و چه ژنهایی هستند که هوش انسان را تعیین میکنند؟ |
|
ژن های هوش در طول دهه گذشته، مطالعات انجمن گسترده ژنوم (GWAS) به ابزاری قدرتمند برای بررسی ژنهای زمینهساز تنوع در بسیاری از صفات و بیماریهای انسانی تبدیل شد ( بوش و مور، 2012 ). مطالعات GWAS برای ارتباط بین فنوتیپها و انواع ژنتیکی - پلیمورفیسمهای تک نوکلئوتیدی (SNPs) - در گروههای بزرگی از افراد غیرمرتبط آزمایش میکنند. اگرچه اکثریت بزرگ SNP ها تاثیر حداقلی بر مسیرهای بیولوژیکی دارند، برخی از SNP ها همچنین می توانند پیامدهای عملکردی داشته باشند و باعث تغییرات اسید آمینه شوند و در نتیجه منجر به شناسایی زمینه های ژنتیکی یک بیماری یا یک صفت شوند ( بوش و مور، 2012 ). پس از اینکه موج اول مطالعات هوشی GWAS عمدتاً نتایج غیرقابل تکراری به همراه داشت ( Butcher et al., 2008 ; Davies et al., 2011 , 2015 , 2016 ; Trampush et al., 2017 ) آشکار شد که هوش بسیار چند ژنی است. برای شناسایی قابل اعتماد ژن های کمک کننده، به اندازه نمونه و صفت بسیار بیشتری نیاز است ( Plomin and von Stumm، 2018 ). متاآنالیز 31 گروه اول ( N = 53,949) تنها توانست 2/1 درصد از واریانس عملکرد شناختی کلی را در یک نمونه مستقل پیش بینی کند و تجزیه و تحلیل مسیر بیولوژیکی یافته های قابل توجهی ایجاد نکرد ( دیویس و همکاران، 2015).). استفاده از پیشرفت تحصیلی به عنوان فنوتیپ پروکسی هوش، هم حجم نمونه و هم تعداد ژن های مرتبط یافت شده را افزایش داد. میزان تحصیلات تعداد سالهایی است که در آموزش تمام وقت صرف شده است. هم از نظر فنوتیپی ( Deary et al., 2010 ) و هم از نظر ژنتیکی ( Trampush et al., 2017 ) به شدت با IQ همبستگی دارد. از آنجایی که تعداد سال های تحصیلی یکی از پارامترهای رایج و معمول جمع آوری شده است، این رویکرد در آخرین مطالعات GWAS، حجم نمونه را به 400000 نفر افزایش داد ( Okbay et al., 2016 ). حتی اندازه نمونه های بزرگتر با ترکیب GWAS برای توانایی شناختی با پیشرفت تحصیلی به دست آمد ( لام و همکاران، 2017 ؛ ترامپوش و همکاران، 2017).) و با تمرکز بر GWAS هوش در گروههای چندگانه ( Savage et al., 2018 ; Zabaneh et al., 2018 ). ژن های هوش شناسایی شده توسط این مطالعات چیست؟ |
|
|
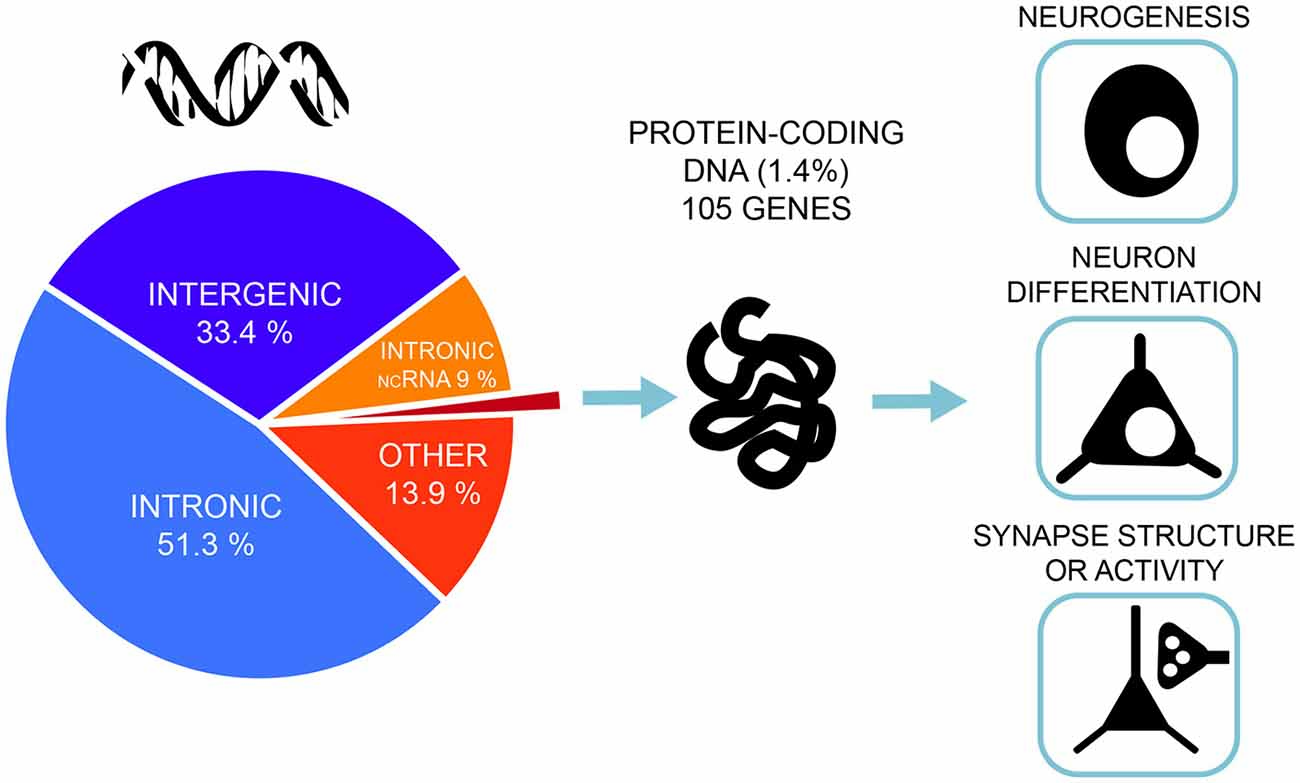
شکل 2 . بیشتر انواع ژنتیکی مرتبط با هوش در مناطق غیر کد کننده DNA نهفته است - تنها 1.4٪ از پلی مورفیسم های تک نوکلئوتیدی مرتبط (SNPs) انواع اگزونیک و غیر مترادف هستند و در ژن های کد کننده پروتئین قرار دارند. تجزیه و تحلیل مجموعه ژن مسیرهای مرتبط با نوروژنز، تمایز نورون و ساختار سیناپسی را در بر می گیرد. این شکل بر اساس نتایج جدیدترین و بزرگترین مطالعات ارتباط ژنومی (GWAS) هوش توسط Savage و همکاران است. (2018) . |
|
بنابراین، تأثیرات ژنتیکی بر توانایی شناختی به احتمال زیاد مستقل از عوامل محیطی عمل نمیکند، بلکه خود را از طریق رونویسی تنظیمشده سیگنال که توسط تجربه هدایت میشود، نشان میدهد. این فعل و انفعال بین اثرات اپی ژنتیکی از طریق عناصر تنظیمی و ساختار ژنتیکی همچنین افزایش وراثت پذیری هوش با افزایش سن را توضیح می دهد ( برگن و همکاران، 2007 ؛ دیویس و همکاران، 2008 ؛ پلومین و دیاری، 2015).). همان ژنهای تنظیمکننده به تعاملات ژن-محیط مناسب نیاز دارند تا نقش خود را در توانایی شناختی آشکار کنند. به عبارت دیگر، در طول رشد، همان مجموعه ای از ژن ها تأثیر فزاینده ای بر هوش پیدا می کند زیرا سطوح اولیه توانایی شناختی از طریق انتخاب محیط ها و آموزش سازگار با آن سطوح توانایی تقویت می شود ( بریلی و تاکر-دروب، 2013 ؛ پلومین و فون) . استوم، 2018 ). |
|
بیشتر ژن ها در طول تکامل عصبی فعال هستند بسیاری از نتایج GWAS ژنها و مسیرهای بیولوژیکی را شناسایی میکنند که عمدتاً در طول مراحل متمایز رشد مغز قبل از تولد فعال هستند ( برگن و همکاران، 2007 ؛ اوکبای و همکاران، 2016 ؛ لام و همکاران، 2017 ؛ اسنیکرز و همکاران، 2017 ؛ ترمپوشت . al., 2017 ). تعدادی از این ژنها قبلاً در ناتوانی ذهنی یا تأخیر رشد دخیل بودند ( Coleman et al., 2019 ). به طور خاص، برخی از ژنها با جهشهای شناخته شده با تأثیر زیاد در بیماریهای روانی، اثرات تنظیمی کوچکتری بر شناخت نشان میدهند، که نشاندهنده منحنیهای دوز-پاسخ طبیعی در رابطه با عملکرد ژن است ( Trampush et al., 2017 ; Coleman et al., 2019 ). ترکیب دادههای SNP با دادههای رونوشت نشان داد که ژنهای کاندید بیان فوقالعادهای را در مغز در طول زندگی نشان میدهند، اما سطوح بیان بالاتری را در مغز در طول رشد پیش از تولد نشان میدهند ( Okbay et al., 2016 ). هنگامی که ژنها به خوشههای عملکردی گروهبندی شدند، بسیاری از این خوشههای مرتبط با پیشرفت تحصیلی عمدتاً در مراحل مختلف رشد عصبی درگیر میشوند: تکثیر سلولهای پیشساز عصبی و تخصصی شدن آنها، مهاجرت نورونهای جدید به لایههای مختلف قشر، پیشبینی. آکسون ها از نورون ها به هدف سیگنال دهی آنها و جوانه زدن دندریتیک ( Okbay et al., 2016)). همچنین برای هوش، تجزیه و تحلیل مجموعه ژن، نوروژنز، تمایز عصبی و تنظیم توسعه سیستم عصبی را به عنوان عملکردهای اصلی SNP های شناسایی شده شناسایی می کند ( Savage et al., 2018 ؛ شکل 2 ). برخی از نمونههای جدیدترین GWAS هوش شامل ژنهایی با عملکردهای شناخته شده در تکثیر سلولی و میتوز میشود: ژن GNL3 در تکثیر سلولهای بنیادی نقش دارد، NCAPG کروموزومها را در طول میتوز تثبیت میکند و DDX27 ساختار ثانویه RNA را تغییر میدهد و در جنینزایی، رشد سلولی و نقش دارد. بخش ( هماهنگان منابع NCBI، 2017 ؛ Savage و همکاران، 2018 ). در نهایت، بزرگترین و غنیترین خوشه ژنهای مرتبط با پیشرفت تحصیلی حاوی ژنهایی با فعالیت کوفاکتور رونویسی است ( Okbay et al., 2016).حمایت از نقش ژن های کاندید در توسعه عصبی و تنظیم بیان ژن. در واقع، بسیاری از ژنهای کدکننده پروتئین، که در آخرین GWAS هوش شناسایی شدهاند، محصولاتی را تولید میکنند که حاوی حوزههای برهمکنش DNA و RNA هستند، مانند انگشتان روی و دامنههای انگشت حلقه (ZNF446، MZF1، ZNFX1، ZNF638، RNF123)، یا اتصال RNA شناخته شده. شرکا (RBFOX و CELF4؛ هماهنگکنندگان منابع NCBI، 2017 ؛ Savage و همکاران، 2018 ). |
|
ژنهای دخیل در تعاملات سلولی بسیاری از ژن های شناسایی شده که در رشد عصبی نقش دارند ممکن است به عملکرد سیناپسی و انعطاف پذیری کمک کنند. عملکرد مغز متکی به فرآیندهای بسیار پویا و وابسته به فعالیت است که ژن ها را روشن و خاموش می کند. این می تواند منجر به تغییرات ساختاری و عملکردی عمیق شود و شامل تشکیل سیناپس های جدید و حذف سیناپس های استفاده نشده، تغییرات در اسکلت سلولی، تحرک گیرنده و متابولیسم انرژی باشد. توانایی شناختی ممکن است به این بستگی دارد که نورون های کارآمد چگونه می توانند این فرآیندها را تنظیم کنند. تعامل سلول ها با محیط مستقیم آنها یک عملکرد اساسی در توسعه عصبی و عملکرد سیناپسی است. بسیاری از ژنهای برتر کدکننده پروتئین مرتبط با توانایی شناختی، پروتئینهای لنگردار غشایی هستند که مسئول ارتباطات سلول به سلول و سلول به ماتریس هستند. مثلا، ژن ITIH3 که پروتئینی را کد می کند که ماتریکس خارج سلولی را تثبیت می کند. مثال دیگر ژن LAMB2 است که لامینین را کد می کند، یک گلیکوپروتئین ماتریکس خارج سلولی که جزء اصلی غشای پایه است. همچنین چندین ژن کادرین، PCDHA1 تا PCDHA7، CDHR4 که در چسبندگی سلولی نقش دارند، با توانایی شناختی مرتبط هستند.هماهنگ کنندگان منابع NCBI، 2017 ; ساویج و همکاران، 2018 ). علاوه بر این، در یک گروه IQ بسیار بالا، ژنی که به طور قابل توجهی برای ارتباط غنی شده است ADAM12 است، یک پروتئین لنگردار غشایی که در تعاملات سلول-سلول و سلول-ماتریکس نقش دارد ( زبانه و همکاران، 2018 ). در نهایت، برخی از ژنهای کاندید که مولکولهای چسبندگی سلولی را کد میکنند (DCC و SEMA3F؛ Savage و همکاران، 2018 ) به طور خاص در هدایت آکسون در طول رشد عصبی نقش دارند. برخی از ژن های کاندید در تنظیم مسیرهای سیگنالینگ مختلف از طریق گیرنده های سطحی نقش دارند. چنین نمونه هایی شامل DMXL2 است که مسیر سیگنالینگ Notch را تنظیم می کند. پپتیداز سیگنال پپتید SPPL2C مانند 2C، پروتئین انگشت حلقه RNF43 43 که به طور منفی مسیرهای سیگنال دهی Wnt را تنظیم می کند ( Savage et al., 2018 ) و ژن WNT4 که پروتئین های سیگنالینگ ترشح شده را کد می کند ( Sniekers et al., 2017, 2017 ; . این مسیرهای سیگنالینگ نقش اساسی در جنین زایی، تکثیر سلولی، مهاجرت، و همچنین ارتباطات سیناپسی در طول رشد دارند. بهطور قابلتوجهی، نمایهسازی ژن با وضوح سلولی در مقیاس بزرگ اخیر، تفاوتهای خاص گونه را دقیقاً در همان دستههای عملکردی ژنهای دخیل در ارتباطات بین سلولی شناسایی کرده است ( زنگ و همکاران، 2012 ). با متضاد پروفیلهای بیان ژن موش و انسان در نئوکورتکس، تفاوتهای بین گونهای در بیان ژن شامل پروتئین ترشح شده (48%)، ماتریکس خارج سلولی (50%)، چسبندگی سلولی (36%) و لیگاند پپتیدی (31%) بود. این نتایج ممکن است اهمیت تعاملات سلول به محیط را نه تنها برای هوش انسانی بلکه برای تکامل انسان به طور کلی برجسته کند. |
|
ژن های عملکرد سیناپسی و پلاستیسیته برخی از یافته های هوش GWAS مستقیماً به ژن هایی با عملکردهای شناخته شده در ارتباطات سیناپسی، انعطاف پذیری و تحریک پذیری عصبی اشاره می کند. برخی از ژن های شناسایی شده در درجه اول در سازماندهی پیش سیناپسی و انتشار وزیکول نقش دارند. یکی از آن ها TSNARE1 است که دامنه t-SNARE حاوی 1 را کد می کند ( Savage و همکاران، 2018 ). نقش اصلی پروتئین های SNARE واسطه اتصال وزیکول های سیناپسی با غشای پیش سیناپسی در نورون ها و همجوشی وزیکول است ( NCBI Resource Coordinators, 2017). علاوه بر این، حداقل دو ژن شناسایی شده دیگر نیز در قاچاق وزیکول نقش دارند: GBF1 واسطه قاچاق تاولی در دستگاه گلژی است و ARHGAP27 در اندوسیتوز با واسطه کلاترین نقش دارد. در نهایت، ژن BSN برای یک پروتئین داربستی که در سازماندهی اسکلت سلولی پیش سیناپسی نقش دارد، کد می کند. یکی از فعالکنندههای رونویسی مرتبط با هوش، اتصال عنصر پاسخگو cAMP 3L4 (CREB3L4) است. این ژن یک CREB را کد می کند - یک پروتئین هسته ای که رونویسی ژن ها را تعدیل می کند. این یک جزء مهم از رویدادهای سیگنالینگ درون سلولی است و عملکردهای بیولوژیکی گسترده ای دارد. با این حال، در نورونها، مستندترین و به خوبی مطالعهشدهترین نقش آن، تنظیم شکلپذیری سیناپسی، یادگیری و تشکیل حافظه است ( سیلوا و همکاران، 1998 ). استفاده از پایگاههای اطلاعاتی اهداف دارویی و حاشیهنویسیهای ژنی آنها میتواند نور جدیدی را بر ارتباط مجموعههای ژن دارو با یک فنوتیپ روشن کند ( گاسپار و برین، 2017 ). چنین تجزیه و تحلیل مسیر دارویی همراه با نتایج هوش GWAS نشان داد که اهداف ژنی دو داروی درگیر در تنظیم سیناپسی و تحریک پذیری نورون به طور قابل توجهی غنی شده است: یک مسدود کننده کانال کلسیم نوع T و یک مهار کننده کانال پتاسیم ( لام و همکاران، 2017 ) . . در یک تجزیه و تحلیل مرتبط از کلاسهای دارویی، غنیسازی قابلتوجهی برای زیرواحدهای کانال کلسیم دردار ولتاژ مشاهده شد ( لام و همکاران، 2017 ). در مطالعه دیگری، ژنهای دخیل در تنظیم مجموعه کانال کلسیمی دارای ولتاژ نیز به طور قابلتوجهی با پیشرفت تحصیلی در مطالعه قبلی مرتبط بودند.Okbay و همکاران، 2016 ). هر دو نوع کانال یونی نقش مهمی در ارتباطات سیناپسی و شلیک پتانسیل عمل دارند. کانال های کلسیم نوع T در شروع پتانسیل عمل و جابجایی بین حالت های متمایز شلیک نقش دارند ( Cain and Snutch, 2010 ). کانالهای پتاسیم برای رپلاریزاسیون سریع در طول تولید AP و حفظ پتانسیل غشاء در حال استراحت بسیار مهم هستند ( Hodgkin and Huxley, 1952 ). |
|
ژن هایی با عملکردهای حمایتی مغز انسان حداقل 20 درصد انرژی مصرفی کل بدن را مصرف می کند. بیشتر این تقاضای انرژی به پتانسیل های پس سیناپسی تولید می شود ( اتول و لافلین، 2001 ؛ ماگیسترتی و آلامن، 2015 ). قابل توجه، ظهور عملکردهای شناختی بالاتر در انسان در طول تکامل نیز با افزایش بیان ژن های متابولیسم انرژی همراه است ( Magistreti and Allaman, 2015 ). بنابراین، ژنهای دخیل در تامین انرژی و متابولیسم میتوانند بر حفظ شلیک با فرکانس بالا در طول وظایف شناختی تأثیر بگذارند. در واقع، توانایی شناختی با تنوع ژنتیکی در چندین ژن مرتبط است که برای تنظیمکنندههای عملکرد میتوکندری کد میکنند - GPD2، NDUFS3، MTCH2 ( NCBI Resource Coordinators، 2017 ).ساویج و همکاران، 2018 ). میتوکندری ها برای فرآیندهای سلولی مختلف که شامل متابولیسم انرژی، سیگنال دهی کلسیم داخل سلولی و تولید گونه های اکسیژن فعال هستند، مرکزی هستند. آنها با تطبیق عملکرد خود با نیازهای فعالیت عصبی، نقش اساسی در رفتار پیچیده نورون ها ایفا می کنند ( Kann and Kovács, 2007 ). علاوه بر این، ژنهای دخیل در متابولیسم لیپید (BTN2A1 و BTN1A1) و متابولیسم گلوکز و اسید آمینه (GPT) از جمله ژنهای کاندید هوش هستند. یکی دیگر از دستههای قابل توجه ژنهای کدکننده پروتئین که در هوش نقش دارند، ژنهایی هستند که برای پروتئینهای مرتبط با میکروتوبولها کد میکنند. میکروتوبول ها بخش مهمی از اسکلت سلولی هستند و در حفظ ساختار سلولی در طول تکامل نقش دارند. در عین حال، میکروتوبول ها بزرگراه های مهم حمل و نقل درون سلولی هستند و در نتیجه بر بازیافت گیرنده های سیناپسی و انتشار انتقال دهنده های عصبی در نورون ها تأثیر می گذارند ( Hernández and Ávila, 2017 ). ژن MAPT که برای پروتئین مرتبط با میکروتوبول کد می کند توسط چندین مطالعه با هوش مرتبط بود ( Sniekers et al., 2017 ; Trampush et al., 2017 ; Savage et al., 2018 ; Coleman et al., 2019.). MAPT همچنین در بسیاری از بیماری های مغزی تغییر می کند - بیماری آلزایمر، بیماری پارکینسون و بیماری هانتینگتون ( هرناندز و اویلا، 2017 ). به غیر از MAPT، برخی از ژنهای کدکننده پروتئینهای مرتبط با میکروتوبول به طور قابلتوجهی با هوش مرتبط هستند: سرین/ترئونین کیناز 3 مرتبط با میکروتوبول (MAST3)، عملکردهای ALMS1 در سازماندهی میکروتوبولها و SAXO2 (FAM154B) یک پروتئین تثبیتکننده میکروتوبول ( منبع NCBI ) Coordinators، 2017 ؛ Savage و همکاران، 2018 ). |
|
نتیجه گیری از مطالعات ژنتیک در نتیجه، مطالعات دوقلو نشان میدهد که تفاوتهای فردی در هوش انسان را میتوان تا حد زیادی (۵۰ تا ۸۰ درصد) با تأثیرات ژنتیکی توضیح داد که هوش را به یکی از ارثیترین صفات تبدیل میکند. با این حال، مطالعات GWAS کنونی میتواند کمتر از نیمی از این وراثتپذیری را به تصویر بکشد (21٪-22٪؛ Lam و همکاران، 2017 ؛ Trampush و همکاران، 2017 ؛ Savage و همکاران، 2018 ؛ Coleman و همکاران، 2019 ). علاوه بر این، تأثیرات ژنتیکی به اثرات کوچک توسط تعداد زیادی از ژن ها نسبت داده می شود. نود و پنج درصد از این گونه های ژنتیکی در نواحی اینترونیک و بین ژنی قرار دارند و ممکن است عملکرد تنظیم کننده ژن داشته باشند. تنها بخش بسیار کمی از SNP های مرتبط (1.4٪) در قطعات DNA که به پروتئین ترجمه می شوند قرار دارند. اکثر ژنهای مرتبط در رشد اولیه، احتمالاً پیش از تولد، با برخی از ژنها برای عملکرد سیناپسی و انعطافپذیری در طول عمر ضروری هستند. این واقعیت که ویژگیهایی مانند طول/وزن تولد و طول عمر، همبستگیهای چند ژنی قوی با عملکرد شناختی نشان میدهند ( لام و همکاران، 2017 ؛ ترمپوش و همکاران، 2017 ) نشان میدهد که رشد سالم کلی پیشنیاز برای عملکرد شناختی بهینه است. GWAS ارتباط احتمالی بین ژن ها و فنوتیپ را آزمایش می کند. با این حال، در دسترس بودن دادههای رونوشت نوع سلول و بافت خاص از مغز انسان پس از مرگ ( Ardlie et al., 2015)) افق جدیدی را برای مطالعات GWAS گشوده است. پیوند دادن دادههای GWAS به پروفایلهای رونویسی نوع سلول و بافت خاص (GTEx) ممکن است نشان دهد که در کدام ناحیه مغز و حتی کدام نوع سلولها ژنهای هوشی به طور بالقوه بیان میشوند. این رویکرد اخطارهای آشکاری دارد، زیرا ژنهای مرتبط با هوش لازم نیست در زمان رشد یکسان بیان شوند، و از آنجایی که مکانهای مغز درگیر در هوش به طور گسترده توزیع شدهاند، لازم نیست همه ژنها در یک ناحیه مغز یا نوع سلول بیان شوند. با این وجود، با استفاده از این رویکرد، مشخص شد که ژنهای مرتبط با پیشرفت تحصیلی و هوش ترجیحاً با هم در بافت عصبی بیان میشوند ( Okbay et al., 2016 ; Lam et al., 2017 ; Trampush et al., 2017 ;ساویج و همکاران، 2018 ; کلمن و همکاران، 2019 ). به طور خاص، مناطق هیپوکامپ، مغز میانی و به طور کلی قشر و قشر پیشانی بالاترین غنیسازی بیان این ژنها را نشان میدهند ( Savage et al., 2018 ; Coleman et al., 2019 ). به استثنای مغز میانی، اینها نواحی مغزی هستند که قبلاً توسط مطالعات تصویربرداری مغز در هوش نقش داشتند. پروفایل های بیان خاص نوع سلولی ژن های هوش نقش انواع سلول های عصبی را برجسته می کند. اگرچه سلولهای گلیا فراوانترین نوع سلول در مغز انسان هستند ( Vasile et al., 2017 )، هیچ مدرکی مبنی بر غنیسازی ژنهای کاندید در الیگودندروسیتها یا آستروسیتها یافت نشد ( لام و همکاران، 2017 ؛ Trampush و همکاران، 2017 ) . قرار دادن نورون ها به عنوان حامل اصلی تنوع ژنتیکی. تجزیه و تحلیل عمیق بیشتر انواع نورون ها غنی سازی قابل توجهی از ژن های مرتبط در نورون های هرمی در ناحیه هیپوکامپ CA1 و نواحی حسی تنی قشر مغز را نشان داد. علاوه بر این، ارتباط قابل توجهی در نوع سلول اصلی در جسم مخطط یافت شد - نورونهای خاردار متوسط ( Savage et al., 2018 ; Coleman et al., 2019)). نورون های هرمی فراوان ترین نوع نورون ها در نئوکورتکس و هیپوکامپ هستند، ساختارهایی که با عملکردهای اجرایی بالاتر، تصمیم گیری، حل مسئله و حافظه مرتبط هستند. نورونهای خاردار متوسط مخطط 95 درصد از انواع نورونهای موجود در جسم مخطط را تشکیل میدهند، ساختاری که مسئول انگیزه، پاداش، یادگیری عادت و خروجی رفتاری است ( Volkow et al., 2017 ). نتایج مطالعات GWAS این فرضیه را مطرح میکند که این نوع نورونها در حمایت از هوش نقش دارند ( کلمن و همکاران، 2019 ). آیا شواهدی وجود دارد که خواص خاصی از سلول های مغز به |
|
سلول های هوش |
|---|
|
سلول های هوش از زمانی که رامون و کاخال دکترین نورونی خود را در مورد پردازش اطلاعات فرض کرد که نورون ها را پروانه های روح می نامد ( Cajal, 1893 )، علم اعصاب پذیرفته است که اساس هوش انسان باید در نورون ها یا شبکه های عصبی باشد. با این حال، جستجوی علوم اعصاب برای پایه بیولوژیکی هوش تا کنون تقریباً به طور انحصاری بر سطح ماکروسکوپی مغز و ژنتیک هوش متمرکز بوده است و شکاف بزرگی از دانش را در سطح سلولی به جا گذاشته است. ما فرض می کنیم که ذهن ما از طریق فعالیت 86 میلیارد نورون ( Herculano-Houzel, 2012 ) و اتصالات آنها عمل می کند، که بلوک های سازنده اصلی برای کدگذاری، پردازش و ذخیره اطلاعات در مغز را تشکیل می دهند و در نهایت منجر به شناخت می شوند ( سالیناس و سجنوفسکی، 2001 ). با توجه به تعداد نجومی اتصالات عصبی ( دراخمن، 2005 )، حتی کوچکترین تغییر در کارایی پردازش اطلاعات توسط نورون ها می تواند به تفاوت های زیادی در توانایی شناختی تبدیل شود. در واقع، یکی از قویترین و قابل تکرارترین تداعیها در روانشناسی رفتاری، هوش با سرعت پردازش ذهنی است که با زمانهای واکنش توسط آزمودنیهای انسانی اندازهگیری میشود ( ورنون، 1983 ؛ بارت و همکاران، 1986).). با این حال، مطالعات بسیار کمی تلاش کردند به این سوال پاسخ دهند که آیا فعالیت و ساختار سلول های عصبی منفرد انسان از هوش انسان پشتیبانی می کند و چگونه پردازش ذهنی سریعتر توسط خواص سلول های مغز ما انجام می شود. این شکاف دانشی تعجبآور نیست: دسترسی به نورونها در مغز انسان زنده بسیار محدود است و بیشتر آنچه در مورد عملکرد نورونها شناخته شده است، از تحقیقات آزمایشگاهی حیوانات ناشی میشود. در طول دهههای گذشته، استفاده از بافت مغز برداشته شده در طول درمان جراحی مغز و اعصاب صرع یا تومور، راههای جدیدی را برای مطالعه مغز انسان در سطح سلولی باز کرده است ( مولنار و همکاران، 2008 ؛ تستا-سیلوا و همکاران، 2010 ، 2014 ). ورهوگ و همکاران، 2013 ، 2016). جراحان مغز و اعصاب برای دستیابی به ساختارهای عمیق مغز آسیبدیده، نئوکورتکس غیر پاتولوژیک را که میتواند برای بررسی بیشتر به آزمایشگاه منتقل شود، برش میدهند. در ترکیب با تست شناختی قبل از جراحی، این رویکرد فرصتی عالی برای مطالعه عملکرد نورون ها در رابطه با هوش انسان ارائه می دهد. چنین استفاده ای از بافت زنده مغز انسان از جراحی مغز و اعصاب را نمی توان با تکنیک های دیگر جایگزین کرد: بافت پس از مرگ عموماً برای مطالعات فیزیولوژیکی مناسب نیست (اما به کرامویس و همکاران، 2018 مراجعه کنید )، در حالی که مطالعات تصویربرداری مغز فاقد دقت سلولی لازم است. |
|
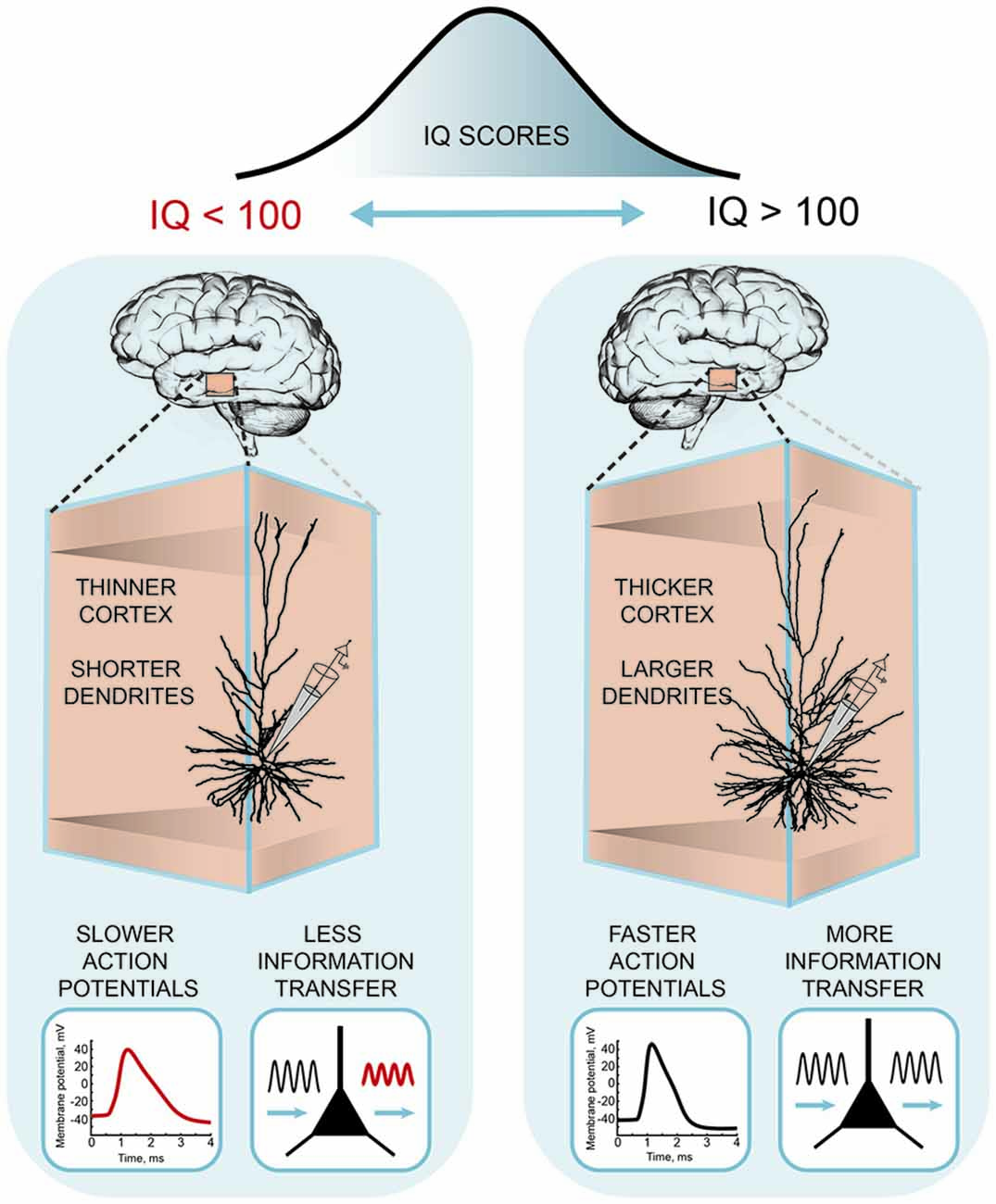
نقش کلیدی نورون های هرمی مطالعات ژنتیکی نشان میدهد که بیان ژنهای مرتبط با هوش در نورونهای هرمی قشری انباشته میشود ( Savage et al., 2018 ; Coleman et al., 2019 ). مقایسه ویژگیهای سلولی کلیدی نورونهای هرمی در میان گونهها ممکن است بینشی در مورد اهمیت عملکردی چنین تفاوتهایی برای شناخت انسان ارائه دهد. در واقع، بافت انسانی مورد استفاده در تحقیقات همیشه از نواحی ارتباطی مرتبه بالاتر، معمولاً قشر گیجگاهی، به منظور در امان ماندن از عملکردهای حسی و زبانی اولیه بیمار می آید. این دقیقاً همان مناطقی است که تصویربرداری مغز در هوش انسان نقش دارد. کدام ویژگی های نورون های هرمی از قشر گیجگاهی در مقایسه با گونه ها برجسته است؟ اول، ساختار سلول های هرمی متفاوت است ( الستون و فوجیتا، 2014 ): در مقایسه با جوندگان و ماکاک ها، سلول های هرمی لایه 2/3 انسان دارای دندریت های سه برابر بزرگتر و پیچیده تری هستند ( Mohan et al., 2015 ). علاوه بر این، این دندریتهای بزرگ دو برابر بیشتر از نورونهای هرمی جوندگان سیناپس دریافت میکنند ( DeFelipe et al., 2002 ). جدای از تفاوتهای ساختاری، نورونهای هرمی انسان تعدادی ویژگی عملکردی منحصربهفرد را نشان میدهند. سیناپسهای تحریککننده انسان 3 تا 4 برابر سریعتر از سیناپسهای قشر جوندگان از افسردگی بهبود مییابند، پتانسیلهای عمل سریعتری دارند و اطلاعات را تا 9 برابر بیشتر از سیناپس موش انتقال میدهند ( Testa-Silva et al., 2014 ). علاوه بر این، نورونهای انسان بالغ میتوانند رویدادهای سیناپسی را در یک پنجره زمانی بسیار وسیعتر برای انعطافپذیری مرتبط کنند ( Testa-Silva et al., 2010 ؛ Verhoog et al., 2013 ). این تفاوتها در بین گونهها ممکن است فشار تکاملی را بر ساختار دندریتی و عملکرد عصبی در لوب تمپورال نشان دهد و بر سازگاریهای خاص سلولهای هرمی انسانی در عملکردهای شناختی این مناطق مغز تأکید کند. اخیراً، این تفاوتها در عملکرد و ساختار نورون هرمی انسان با نمرات هوش و ساختار تشریحی لوبهای تمپورال از همان افراد مرتبط بود ( Goriunova و همکاران، 2018 ؛ شکل 3 ). نتایج نشان داد که نمرات IQ بالا با ضخامت قشر گیجگاهی بیشتر در بیماران جراحی مغز و اعصاب، مانند افراد سالم مرتبط است ( چوی و همکاران، 2008).). علاوه بر این، قشر تمپورال ضخیمتر به دندریتهای بزرگتر و پیچیدهتر نورونهای هرمی انسان مرتبط است. ترکیب این مورفولوژی های دندریتی واقعی در مدل محاسباتی نشان داد که نورون های مدل بزرگتر قادر به پردازش ورودی های سیناپسی با دقت زمانی بالاتر هستند. انتقال اطلاعات بهبودیافته توسط نورون های مدل به دلیل پتانسیل عمل سریعتر در سلولهای بزرگتر بود. در نهایت، همانطور که توسط مدل پیشبینی شد، ضبطهای تجربی افزایش پتانسیل عمل در نورونهای هرمی انسان نشان داد که افراد با نمرات IQ بالاتر میتوانند پتانسیلهای عمل سریع را در طول فعالیت عصبی حفظ کنند. این یافتهها اولین شواهدی را ارائه میدهند که هوش انسان با نورونهای بزرگتر و پیچیدهتر و پتانسیلهای عمل سریعتر و انتقال اطلاعات سیناپسی کارآمدتر مرتبط است.گوریونوا و همکاران، 2018 ). |
|
شکل 3 . پایه سلولی هوش انسانی نمرات ضریب هوشی بالاتر با دندریتهای بزرگتر، پتانسیلهای عمل سریعتر در طول فعالیت عصبی و ردیابی اطلاعات کارآمدتر در نورونهای هرمی قشر تمپورال مرتبط است. این شکل بر اساس نتایج Goriounova و همکاران است. (2018) . |
|
سطوح اتصال: ژن ها، سلول ها، شبکه ها و نواحی مغز سلول های هرمی، به ویژه در لایه های سطحی مناطق ادغام چندوجهی مانند قشر گیجگاهی یا فرونتال، یکپارچه کننده و تجمع کننده اصلی اطلاعات سیناپسی هستند. دندریت های بزرگتر می توانند از نظر فیزیکی حاوی تماس های سیناپسی بیشتری باشند و اطلاعات بیشتری را پردازش کنند. در واقع، دندریت های نورون هرمی انسان دو برابر سیناپس های موجود در جوندگان دریافت می کنند ( DeFelipe et al., 2002 ). افزایش ظرفیت یکپارچهسازی اطلاعات این نواحی مغز نیز در شیب پیچیدگی سلولهای هرمی در نواحی قشر مغز منعکس میشود - سلولها دارای دندریتهای بزرگتر در مناطقی هستند که در پردازش قشری مرتبه بالاتری دارند ( الستون و همکاران، 2001 ؛ جاکوبز و همکاران). ، 2001 ، الستون، 2003 ، الستون و فوجیتا، 2014; ون دن هوول و همکاران، 2015 ). هم در انسان و هم در سایر نخستیها، اتصال کل مغز قشر مغز به طور مثبت با اندازه دندریتهای سلول هرمی همبستگی مثبت دارد ( Scholtens و همکاران، 2014 ؛ ون دن هوول و همکاران، 2015 ). به طور کلی، طول دندریتی بیشتر در نورونهای انسان در مقایسه با سایر گونهها، و بهویژه کشیدگی پایانههای دندریتی پایه آنها ( Deitcher et al., 2017 ) این سلولها را قادر میسازد تا از شاخههای درخت دندریتی خود به عنوان محفظههای محاسباتی مستقل استفاده کنند. اخیرا ایال و همکاران. (2016 ، 2018) با آزمایش مدل های دقیق آنها از جمله سیناپس های تحریکی، خارهای دندریتیک، NMDA دندریتی و میخ های سوماتیک، بینش جدیدی در مورد پردازش سیگنال و قابلیت های محاسباتی سلول های هرمی انسانی ارائه کرده اند ( Eyal et al., 2018)). نتایج نشان میدهد که تعداد زیاد دندریتهای پایه در سلولهای هرمی انسان و افزایش طول پایانههای آنها نسبت به سایر گونهها منجر به جدا شدن الکتریکی پایانههای پایه از یکدیگر میشود. مشاهدات مشابهی نیز اخیراً توسط ضبط های دندریتی از سلول های عصبی هرمی لایه انسانی 5 انجام شده است ( Beaulieu-Laroche et al., 2018 ). به این ترتیب، دندریتهای انسان میتوانند بهعنوان زیرواحدهای چندگانه و نیمه مستقل عمل کنند و در مقایسه با قشر زمانی موش، بهطور مستقل و همزمان، سنبلههای NMDA دندریتیک بیشتری تولید کنند ( Eyal et al., 2014).). سنبله های دندریتیک از طریق گیرنده های NMDA جزء ضروری محاسبات مربوط به رفتار در نورون ها هستند. در موش ها، دستکاری این سنبله ها منجر به کاهش انتخاب جهت گیری نورون های قشر بینایی می شود که عملکرد دندریت ها را به پردازش اطلاعات بصری توسط نورون ها مرتبط می کند ( اسمیت و همکاران، 2013 ). علاوه بر این، دندریت های بزرگتر بر تحریک پذیری سلول ها تأثیر می گذارند ( وتر و همکاران، 2001 ؛ بکرز و هاوسر، 2007 ) و شکل و سرعت پتانسیل های عمل را تعیین می کنند ( ایال و همکاران، 2014 ). افزایش اندازه محفظه های دندریتی در سیلیکو منجر به تسریع شروع پتانسیل عمل و افزایش قابلیت کدگذاری نورون ها می شود ( ایال و همکاران، 2014).; گوریونوا و همکاران، 2018 ). علاوه بر این، در مقایسه با موش، نورونهای هرمی انسان در لایههای سطحی، جریانهای فعال بیشتری از قطبش را نشان میدهند که تحریکپذیری این سلولها را تسهیل میکند ( Kalmbach et al., 2018 ). |
|
بنابراین، دندریتهای بزرگتر سلولها را با مزایای محاسباتی زیادی که برای ادغام سریع و کارآمد مقادیر زیادی از اطلاعات ضروری است، مجهز میکنند. این واقعیت که نورون های بزرگتر و سریعتر انسان در قشر گیجگاهی به هوش مرتبط هستند ( Goriunova et al., 2018)) شواهدی را ارائه می دهد که نشان می دهد زنجیره ای از این ویژگی های سلولی در سراسر جمعیت انسانی وجود دارد. در انتهای بالای توزیع امتیاز IQ، سلولهای هرمی افراد با ضریب هوشی بالا ورودیهای سیناپسی بیشتری دریافت میکنند و میتوانند با پردازش این ورودیهای سیناپسی متعدد به طور جداگانه و همزمان به وضوح بالاتری از یکپارچگی سیناپسی دست یابند. از آنجایی که سلول ها به طور مداوم توسط بار زیادی از سیگنال های دریافتی در طول فعالیت های شناختی بمباران می شوند، نورون باید این ورودی های متعدد را به خروجی منتقل کند. نورونهای انسانی افراد با ضریب هوشی بالاتر میتوانند این ورودیها را به پتانسیلهای عمل - سیگنال خروجی سلول - بسیار کارآمدتر ترجمه کنند، اطلاعات بیشتری را انتقال دهند و در مقایسه با افراد با ضریب هوشی پایینتر، شلیک پتانسیل عمل سریع را حفظ کنند.حایر و همکاران، 1988 ; ساویج و همکاران، 2018 ). در نهایت، مطالعات ژنتیکی هوش همچنین ژنهایی را که از ساختار دندریتی پشتیبانی میکنند در توانایی شناختی انسان نقش دارند. خوشهبندی ژنهای کاندید از GWAS دستاوردهای آموزشی در مجموعههای ژنی با عملکرد بیولوژیکی شناخته شده، مجموعههای ژنی را شناسایی کرد که در مورفولوژی قشر مغز و بهویژه در دندریتها و سازماندهی ستون فقرات دندریتیک نقش دارند ( Okbay et al., 2016 ). علاوه بر این، قوی ترین ارتباط ژنتیکی در حال ظهور با هوش توسط اسنیکرز و همکاران ایجاد شده است. (2017) و بعداً در نمونه بسیار بزرگتری تکثیر شد ( کلمن و همکاران، 2019 ) در ناحیه اینترونیک ژن FOXO3 و پروموتر آن است. ژن FOXO3 بخشی از مسیر سیگنالینگ فاکتور رشد شبه انسولین/انسولین 1 (IGF-1) است ( Costales and Kolevzon, 2016)). به طور قابلتوجهی نشان داده شد که IGF-I باعث افزایش انشعاب و اندازه دندریتیک در قشر حسی جسمی اولیه موش صحرایی، بهویژه در سلولهای هرمی در لایههای قشر سطحی میشود ( Niblock et al., 2000 ). سطوح پایین IGF-1 همچنین با عملکرد شناختی ضعیف در طول پیری ( Aleman et al., 1999 ; Tumati et al., 2016 ) و یک شبکه عملکردی کمتر یکپارچه از مناطق متصل مغز ( Sorrentino et al., 2017 ) مرتبط است. بنابراین، تفاوتهای فردی در بسط دندریتی در سلولهای هرمی تحت کنترل ژنتیکی است، با سازگاریهای عملکردی در این سلولها همراه میشود و زمینهساز تنوع انسان در هوش است |
|
چگونه این یافتهها در سطح سلولی و ژنتیکی به یافتههای مقیاس کلان در تصویربرداری مغز ترجمه میشوند؟ یکی از قویترین یافتهها در تصویربرداری مغز این است که ضخامت و حجم قشر مغز با هوش مرتبط است ( Hier et al., 2004 ; Colom et al., 2006 , 2009 ; Narr et al., 2007 ; Choi et al., 2008 ; Karama . و همکاران، 2009 ). بازسازی ستون قشر مغز در وضوح نانو نشان می دهد که حجم قشر عمدتاً شامل فرآیندهای دندریتی و آکسونی با تعداد 7 برابر بیشتر آکسون نسبت به دندریت ها است ( Kasthuri et al., 2015).تنها بخش کوچکی از این حجم توسط اجسام سلولی اشغال شده است. دندریت ها و آکسون ها ساختارهایی هستند که واسطه شکل پذیری سیناپسی هستند، اطلاعات را ذخیره می کنند و در طول عمر به رشد و تغییر ادامه می دهند. در واقع، در طول رشد طبیعی پس از زایمان، نواحی قشر مغز از یک الگوی مشابه پیروی می کنند: دندریت ها رشد مداومی را نشان می دهند که با افزایش حجم قشر و کاهش تراکم عصبی همراه است ( Huttenlocher, 1990 ). علاوه بر این، نواحی قشر پیشانی که بیشتر بر اساس سن و تجربه شکل میگیرند، دوره زمانی کندتر این تغییرات را در مقایسه با نواحی بینایی اولیه که دوره بحرانی اولیه دارند نشان میدهند ( Huttenlocher، 1990).). در راستای این رشد طولانی مدت، درختان دندریتیک در لوب تمپورال انسان در طول بلوغ و تا سنین پیری به رشد خود ادامه می دهند. در افراد 80 ساله درختان دندریتی گسترده تر از سن 50 سالگی هستند، که بیشتر این تفاوت ها ناشی از افزایش تعداد و متوسط طول بخش های انتهایی درخت دندریتیک است. ارتباط بین اندازه دندریتی و شناخت با این واقعیت مورد تاکید قرار می گیرد که در زوال عقل سالخورده، درختان دندریتیک از گستردگی کمتری برخوردار هستند، عمدتاً به این دلیل که بخش های انتهایی آنها کمتر و کوتاهتر هستند ( Buell and Coleman, 1979 ). همچنین، در داخل قشر انسان، یک گرادیان پیچیدگی دندریتیک در سراسر نواحی قشر وجود دارد. نواحی ارتباطی مرتبه بالاتر که اطلاعات پیچیده تری را ذخیره و پردازش می کنند حاوی نورون هایی با دندریت های بزرگتر و پیچیده تر در مقایسه با مناطق حسی اولیه هستند. در عین حال، تراکم بدن سلول های عصبی در نواحی ارتباط قشری در مقایسه با نواحی حسی اولیه کمتر است ( بیول و کلمن، 1979 ؛ دفلیپ و همکاران، 2002 ؛ الستون، 2003 ). مطالعه اخیر توسط Genç و همکاران. (2018) از تصویربرداری تانسور انتشار چند پوسته برای تخمین چگالی دندریتیک قشری پاریتو- فرونتال در رابطه با شناخت انسان استفاده کرد. این مطالعه نشان داد که نمرات بالاتر در آزمون های شناختی با مقادیر کمتر تراکم نوریت مرتبط است ( Genç et al., 2018 ). با کاهش تراکم نوریت همراه با افزایش طول دندریت ( Huttenlocher, 1990 )، نتایج بدست آمده توسط Genç و همکاران. (2018) ممکن است نشان دهد که نواحی قشری پاریتو- فرونتال در افراد با هوش بالاتر دارای نورون های متراکم کمتری هستند و به این معنی است که این نورون ها دندریت های بزرگ تری دارند. با توجه به نتایج Genç و همکاران. (2018) و گوریونوا و همکاران. (2018)با هم نشان می دهد که مدار عصبی مرتبط با هوش بالاتر به شیوه ای پراکنده و کارآمد سازماندهی شده است. نورونهای هرمی بزرگتر و پیچیدهتر در فضای قشری پراکندهتر هستند و حجم قشر بزرگتری را اشغال میکنند |
|
نتیجه گیری و چشم اندازهای آینده |
|---|
|
تصویربرداری از مغز با اشاره به نواحی آناتومیک ناخالص عملکردی و ساختاری مهم که در هوش دخیل هستند - به طور کلی حجم و ضخامت ماده خاکستری، یکپارچگی ماده سفید و عملکرد در قشر گیجگاهی، پیشانی و جداری، مبنایی برای تحقیقات در مورد نوروبیولوژی هوش فراهم کرده است. با این حال، واضح است که تصویربرداری عصبی در شکل کنونی قادر به ارائه وضوح زمانی و مکانی کافی برای مطالعه بلوکهای ساختمان محاسباتی مغز - نورونها و تماسهای سیناپسی نیست. از سوی دیگر، مطالعات GWAS بر روی دیگر طیف یعنی ژنهای هوش متمرکز شدهاند. با افزایش حجم نمونه و ترکیب گروههای چندگانه، پیشرفت زیادی حاصل شد. نتایج نشان میدهد که 98 درصد از واریانتهای ژنتیکی مرتبط به پروتئین عملکردی کدگذاری نشدهاند و احتمالاً عملکرد تنظیمی در مراحل مختلف رشد عصبی دارند. با این حال، درصد کمی از ژنهایی که پروتئینهای عملکردی تولید میکنند در عملکردهای عصبی مختلف از جمله عملکرد سیناپسی و انعطافپذیری، تعاملات سلولی و متابولیسم انرژی نقش دارند. نکته مهم این است که پایگاهداده رو به رشد پروفایلهای بیان ژن بیان ژنهای مرتبط را به نورونهای اصلی قشر و مغز میانی - نورونهای هرمی و خاردار متوسط - مشخص کرده است. عصب شناسی سلولی در بافت مغز انسان برداشته شده می تواند دیدگاه جدیدی ارائه دهد. نتایج اولیه جالب، عملکرد و ساختار سلول های هرمی را با آشکارسازی همبستگی های مثبت بین اندازه دندریتی، سرعت پتانسیل عمل و ضریب هوشی به هوش انسان مرتبط کرده است. با این حال، هنوز بسیاری از سوالات بی پاسخ مانده است. چه نوع نورون هایی در هوش انسان نقش دارند؟ پیشرفتهای اخیر در پروفایل ژنی سلولهای عصبی با وضوح تک سلولی نشان میدهد که حدود 50 نوع سلول ترانسکریپتومیک از سلولهای هرمی در موشها وجود دارد و نواحی مختلف مغز حاوی مجموعههای جدیدی از انواع ترانسکریپتومی هستند ( Tasic et al., 2018 ). اطلاعات موجود در رونوشتها، انواع را به ویژگی هدف دوربرد مخصوص منطقه مرتبط میکند. همین امر را می توان در مورد نورون های خاردار متوسط جسم مخطط نیز گفت، جایی که نقشه پیش بینی اتصال دقیق از کل قشر مغز اجازه می دهد تا 29 حوزه عملکردی مجزا را شناسایی کند ( هینتیریان و همکاران، 2016).). بنابراین، هم نورونهای هرمی و هم نورونهای خاردار متوسط، جمعیتهای بسیار ناهمگنی را تشکیل میدهند که انواع سلولهای مختلف عملکردهای متفاوتی دارند و الگوهای ارتباطی خاص آنها با بقیه مغز دارند. این نوع سلول های موش چگونه با انواع سلول های انسانی مطابقت دارند؟ چگونه انواع سلول های مختلف از هوش عمومی و توانایی های شناختی خاص در مغز انسان پشتیبانی می کنند؟ پاسخها به تلاشهای مقیاس بزرگی نیاز دارد که امکان تجزیه و تحلیل اعداد بزرگ را فراهم میکند، نه تنها گروههای انسانی، بلکه سلولها و انواع سلولها. این ممکن است با ابتکارات مشترک در مقیاس بزرگ اخیر که در سرتاسر جهان آغاز شده است در دسترس باشد ( Brose, 2016 ). |